A tofacitinib-citrát egy vényköteles gyógyszer (Xeljanz kereskedelmi név), amelyet eredetileg a Pfizer fejlesztett ki az orális Janus kináz (JAK) gátlók egy osztályára. Szelektíven gátolja a JAK kinázt, blokkolja a JAK/STAT útvonalakat, ezáltal gátolja a sejtszignál transzdukciót és a kapcsolódó génexpressziót és -aktivációt, a rheumatoid arthritis, arthritis psoriatica, a colitis ulcerosa és más immunbetegségek kezelésére használják.
A gyógyszer három adagolási formát tartalmaz: tabletták, nyújtott hatóanyag-leadású tabletták és belsőleges oldatok. Tablettáit először 2012-ben hagyta jóvá az FDA, a nyújtott hatóanyag-leadású adagolási formát pedig 2016 februárjában hagyta jóvá az FDA. Ez az első a reumás ízületek kezelésére. A Yan egy JAK-gátló, amelyet naponta egyszer szájon át kell bevenni. 2019 decemberében ismét jóváhagyták az elnyújtott hatóanyag-leadású gyógyszerek új javallatát a közepesen súlyos vagy súlyos aktív colitis ulcerosa (UC) kezelésére. Ezen túlmenően a plakkos pikkelysömör jelenlegi 3. fázisú klinikai vizsgálata befejeződött, és további hat, 3. fázisú klinikai vizsgálat van folyamatban, amelyekben aktív arthritis psoriatica, juvenilis idiopátiás ízületi gyulladás, stb. Indikációk. A hosszan tartó hatású, és csak naponta egyszer beveendő, nyújtott hatóanyag-leadású tabletták előnyei elősegítik a betegek betegségeinek kezelését és ellenőrzését.
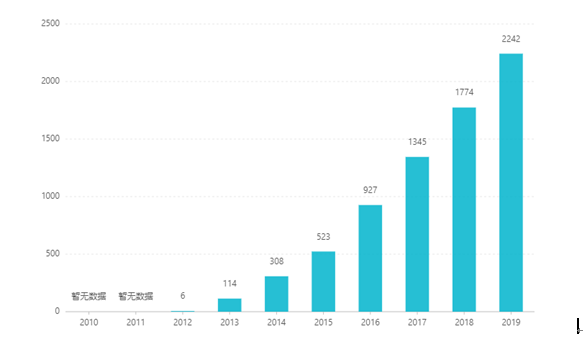
A tőzsdei bevezetése óta értékesítése évről évre nőtt, és 2019-ben elérte a 2,242 milliárd USD-t. Kínában a tabletta adagolási formáját 2017 márciusában engedélyezték a forgalomba hozatalra, és 2019-ben tárgyalások útján bekerült a B kategóriájú egészségbiztosítási katalógusba. az ajánlat 26,79 RMB. A nyújtott hatóanyag-leadású készítmények magas technikai korlátai miatt azonban ez a gyógyszerforma még nem került forgalomba Kínában.
A JAK-kináz fontos szerepet játszik a gyulladásban, és gátlóiról kimutatták, hogy bizonyos gyulladásos és autoimmun betegségeket kezelnek. Eddig 7 JAK-gátlót hagytak jóvá világszerte, köztük a Leo Pharma Delgocitinibét, Celgene Fedratinibjét, Az AbbVie upatinibjét, Az Astellas Pefitinibjét, Eli Lilly Baritinibét és Novartis Rocotinibjét. Kínában azonban csak a tofacitinib, a baritinib és a rokotinib engedélyezett a fent említett gyógyszerek közül. Bízunk benne, hogy a Qilu „Tofatib Citrate Sustained Release Tablets” termékét a lehető leghamarabb jóváhagyják, és ez több beteg számára előnyös.
Kínában az eredeti kutatási tofacitib-citrátot az NMPA 2017 márciusában hagyta jóvá olyan felnőtt RA-s betegek kezelésére, akiknél a metotrexát nem elég hatékony vagy intolerancia a metotrexátot, Shangjie márkanéven. A Meinenet adatai szerint a tofacitib-citrát tabletták eladása a kínai állami egészségügyi intézményekben 2018-ban 8,34 millió jüan volt, ami jóval alacsonyabb, mint a globális eladások. Ennek nagy része az ár. A jelentések szerint a Shangjie kezdeti kiskereskedelmi ára 2085 jüan (5 mg*28 tabletta) volt, a havi költsége pedig 4170 jüan, ami nem kis teher a hétköznapi családok számára.
Érdemes azonban megünnepelni, hogy a tofacitibet a 2019. novemberi tárgyalások után felvette az Országos Egészségbiztosítási Alap 2019. évi „Országos Egészségbiztosítási Alap, Munkabaleset- és Anyasági Biztosító Gyógyszerlistájára”. A hírek szerint a havi díj csökkenni fog. 2000 jüan alá az árcsökkentés tárgyalása után, ami nagyban javítja a gyógyszer elérhetőségét.
A Szellemi Tulajdon Állami Hivatala Szabadalmi Újravizsgáló Testülete 2018 augusztusában a 36902. számú felülvizsgálati határozatot kérte, és érvénytelennek nyilvánította a Pfizertofatib alapszabadalmát, az összetett szabadalmat a leírás elégtelen közzététele miatt. A Pfizertofatiib kristályforma (ZL02823587.8, CN1325498C, bejelentés dátuma: 2002.11.25.) szabadalma azonban 2022-ben lejár.
Az Insight adatbázis azt mutatja, hogy az eredeti kutatáson kívül a Chia Tai Tianqing, Qilu, Kelun, Jangce River és Nanjing Chia Tai Tianqing öt generikus gyógyszerét hagyták jóvá a hazai tofacitinib tabletta készítményben. A nyújtott hatóanyag-leadású tablettatípusra azonban csak az eredeti kutatás, a Pfizer nyújtott be marketingkérelmet május 26-án. A Qilu az első hazai vállalat, amely erre a készítményre vonatkozóan nyújtott be marketingkérelmet. Ezenkívül a CSPC Ouyi a BE próbastádiumában van.
A Changzhou Pharmaceutical Factory (CPF) az API-k, kész készítmények vezető gyógyszergyártója Kínában, amelynek székhelye Changzhou, Jiangsu tartomány. A CPF-et 1949-ben alapították. 2013-tól szenteltük a Tofacitinib-citrátot, és már benyújtottuk a DMF-et. Számos országban regisztráltunk, és a legjobb dokumentumokkal tudjuk támogatni a Tofacitinib-citrátot.
Feladás időpontja: 2021.07.23